На примере механизма образования спор у бактерий удалось показать, что становление нового полезного признака в ходе эволюции может начинаться с мутаций, вносящих элемент хаоса в программу индивидуального развития. Дестабилизация развития приводит к появлению целого набора альтернативных аномальных фенотипов («уродств»), причем выбор одного из возможных путей развития поначалу случаен. Если один из этих путей окажется удачным, отбор в дальнейшем будет закреплять мутации, повышающие вероятность реализации именно этого нового пути развития. В результате новый признак, изначально возникший как редкая аномалия, со временем стабилизируется и становится нормой.
Результаты данного исследования перекликаются с теоретической дискуссией, которая уже много лет идет среди российских эволюционистов. Чтобы понять важность полученных результатов, необходимо вначале ознакомиться с содержанием этой дискуссии. Этому посвящена первая часть заметки. Во второй части рассказывается собственно об исследовании, выполненном американскими микробиологами.
Результаты данного исследования перекликаются с теоретической дискуссией, которая уже много лет идет среди российских эволюционистов. Чтобы понять важность полученных результатов, необходимо вначале ознакомиться с содержанием этой дискуссии. Этому посвящена первая часть заметки. Во второй части рассказывается собственно об исследовании, выполненном американскими микробиологами.
1. Два пути появления эволюционных новшеств
Простейшие эволюционные модели обычно предполагают, что появление новых адаптивных (полезных) признаков идет по следующей схеме:
-Сначала происходит случайная генетическая мутация (изменение ДНК).
-Эта мутация неким вполне определенным образом проявляется в фенотипе, то есть меняет строение, физиологию или поведение организма.
-Если изменение фенотипа повысило «приспособленность» организма (то есть эффективность передачи им своих генов следующим поколениям), то с течением времени частота встречаемости изменившегося (мутантного) гена в популяции будет расти. Этот совершенно автоматический и неизбежный процесс известен под названием «естественного отбора».
-В конце концов мутация может зафиксироваться. Это значит, что частота встречаемости мутантного гена в популяции достигла 100%, и новый фенотипический признак стал «нормой» для всех особей.
Нет сомнений, что во многих случаях всё происходит именно так (или почти так). К примеру, эволюция устойчивости бактерий к антибиотикам отлично описывается этой простейшей схемой (см.: Пути эволюции предопределены на молекулярном уровне, «Элементы», 12.04.2006).
Однако данная модель основана на допущении, которое далеко не всегда справедливо. Речь идет о втором пункте перечня, где предполагается, что фенотипическое проявление мутации является «вполне определенным». На самом деле генетикам отлично известно, что реальные взаимосвязи между изменениями генов и изменениями фенотипа во многих случаях не столь однозначны. Гены вообще определяют фенотип не строго, а вероятностным образом. В общем случае генетическая мутация приводит не к какому-то строго определенному изменению фенотипа, а к изменению вероятностей реализации тех или иных фенотипов, причем эти вероятности зависят не только от самого мутантного гена, но и от «генетического контекста», то есть от других генов генома. Один и тот же мутантный ген у одних особей может привести к резко измененному фенотипу, а у других он может не дать видимого эффекта (даже в гомозиготном состоянии), так что фенотип будет «нормальный». В таких случаях говорят о неполной пенетрантности («проявляемости») мутации.
Дело в том, что наследственная информация, записанная в генах, воплощается в фенотипе в ходе сложного процесса индивидуального развития организма (онтогенеза). Для нормального развития необходима слаженная работа всех генов, поэтому, строго говоря, каждый отдельный фенотипический признак никак не может определяться только одним геном — в конечном счете он зависит от всех генов генома. Поэтому обычно между генами и признаками нет ничего похожего на связь «один к одному».
Изменение, произошедшее на уровне ДНК (мутация), влияет не непосредственно на фенотипический признак, а на ход индивидуального развития. Мутация может отклонить ход развития в ту или иную сторону. Однако онтогенез обычно обладает высокой помехоустойчивостью. В ходе эволюции отбор закрепляет такие генетические изменения, которые повышают способность онтогенеза противостоять нарушениям, компенсировать помехи и возвращаться на «магистральный путь». Эту способность онтогенеза невзирая на помехи приходить к одному и тому же итогу («нормальному» фенотипу) называют эквифинальностью онтогенеза.
Низкая пенетрантность многих вредных мутаций — яркое проявление помехоустойчивости онтогенеза. Во многих случаях развивающемуся организму удается справиться с мутациями, пытающимися нарушить нормальный ход развития. Например, мутантные белки, синтезированные на основе мутантных генов, могут, тем не менее, нормально функционировать, если специализированные белки — шапероны — «насильно» придадут им правильную трехмерную конфигурацию (см.: Когда вредных мутаций много, они не так вредны, «Элементы, 06.12.2005).
Кроме того, необходимо помнить, что генетический контроль индивидуального развития не является абсолютным. При одном и том же геноме фенотип может варьировать (см.: модификационная изменчивость). Кроме генов, на ход развития (и, соответственно, на итоговый фенотип) влияют и другие факторы: например, температура и химический состав среды, в которой происходит развитие.
Самое интересное, что влияние мутаций и резких изменений внешних условий может быть очень похожим. Иными словами, одно и то же изменение фенотипа (например, какое-нибудь уродство) можно получить и в результате мутации, и в результате физического воздействия на развивающийся организм. Например, подвергая личинок дрозофилы тепловому шоку, можно получить такие же уродства, как и те, что возникают в результате мутаций. И наоборот: если взять практически любое уродство, появляющееся в результате перегрева, то в большинстве случаев оказывается, что некоторые мутации могут приводить к такому же уродству без всякого перегрева (или при менее интенсивном перегреве). Это явление называется «генокопированием модификаций». Можно сказать, что у организма уже имеется потенциально возможный альтернативный путь развития, который приводит к реализации нового признака (даже если в нормальных условиях этот путь никогда не реализуется). Нужно лишь подобрать условия — внешние (температуру) или внутренние (мутацию) — в которых эта альтернативная программа сработает.
Отбор обычно способствует повышению роли внутренних (генетических) и снижению роли внешних регуляторов онтогенеза. В результате онтогенез под действием отбора стабилизируется. Это значит, что геном постепенно меняется таким образом, чтобы обеспечивать реализацию «нормального» фенотипа со всё большей и большей вероятностью (онтогенез становится всё более помехоустойчивым).
На основе подобных фактов и рассуждений некоторые исследователи — К. Х. Уоддингтон (C. H. Waddington), И. И. Шмальгаузен (см. также: М. А. Шишкин «Эволюция как эпигенетический процесс») — пришли к выводу, что именно онтогенез (как сложная помехоустойчивая система индивидуального развития) является главным действующим лицом эволюционной драмы. В наиболее абсолютизированной форме эти воззрения отстаивает М. А. Шишкин, который считает, что основной механизм формирования эволюционных новшеств существенно отличается от приведенного выше и выглядит примерно следующим образом:
1) Сильное внешнее воздействие (например, резкое изменение среды) приводит к дестабилизации онтогенеза.
2) Это автоматически приводит к появлению разнообразных аномальных фенотипов (реализуются доселе скрытые альтернативные пути развития).
3) Если какие-то из аномальных фенотипов окажутся «удачными» (адаптивными в новых условиях), отбор в дальнейшем будет закреплять такие мутации, которые будут повышать вероятность реализации именно этого альтернативного пути развития. В результате аномалия постепенно станет новой нормой.
4) В ходе стабилизации новой нормы возникнут новые скрытые альтернативные пути развития, которые смогут реализоваться при следующем «кризисе».
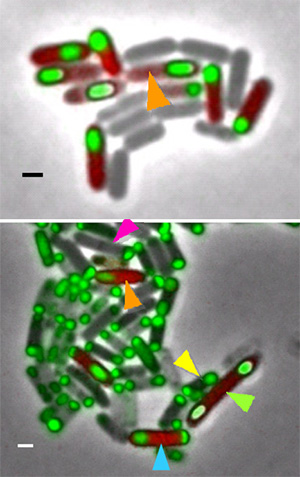
Рис. 1. В ходе споруляции у бактерий Bacillus subtilis в норме всегда образуется по одной споре в каждой клетке, другие варианты не встречаются (вверху; споры окрашены зеленым цветом). У мутантов с дестабилизированным механизмом споруляции (внизу) возможно несколько альтернативных вариантов: 1) нормальная споруляция (оранжевая стрелка), 2) прекращение начавшейся споруляции (сиреневая стрелка), 3) неудачная (приводящая к гибели) попытка образования двух спор в одной материнской клетке (желтая стрелка), 4) успешное формирование двух спор-близнецов (зеленая стрелка). Длина масштабной линейки 1 мкм. Фото из дополнительных материалов (PDF, 3 Мб) к обсуждаемой статье в Nature
Главная особенность этой модели состоит в том, что эволюционное изменение (становление нового «нормального» фенотипа) не начинается с генетических изменений, а заканчивается ими. Новый фенотип сначала появляется как редкая аномалия или «морфоз» — отклонение онтогенеза от нормального пути при неизменном геноме. В дальнейшем отбор постепенно «вписывает» новый путь онтогенеза в геном, фиксирует его на генетическом уровне, то есть делает его всё более «генетически детерминированным», стабильным и помехоустойчивым. По мнению М. А. Шишкина, «эволюционные изменения начинаются с фенотипа и распространяются по мере их стабилизации в направлении генома, а не наоборот». Главное — не путать эти взгляды с ламаркизмом и помнить, что «фиксация эволюционных изменений в геноме» происходит на основе чисто «дарвиновского» механизма, то есть путем закрепления естественным отбором случайных мутаций.
Впрочем, ясно, что первоначальное «возмущающее воздействие» в этой схеме не обязательно должно быть внешним — это может быть и мутация, но не такая, которая сразу приводит к появлению нового стабильного признака, а такая, которая вносит хаос в систему индивидуального развития (дестабилизирует онтогенез).
Эта модель, получившая название «эпигенетической теории эволюции», активно обсуждается российскими эволюционистами, особенно палеонтологами, но мало известна за рубежом.
Чего этой теории сильно не хватает — так это хороших иллюстраций, то есть детальных исследований (в том числе молекулярно-генетических), показывающих реальность данного эволюционного механизма. Статья американских микробиологов, опубликованная недавно на сайте журнала Nature, отчасти восполняет этот пробел. Разумеется, авторы пользуются другой терминологией и не цитируют ни Шмальгаузена, ни Шишкина, хотя, надо отдать им должное, Уоддингтона они всё-таки упомянули.
2. Дестабилизация развития как путь к эволюционным новшествам (на примере образования спор у бактерии Bacillus subtilis)
Почвенная бактерия Bacillus subtilis — излюбленный модельный объект генетиков и молекулярных биологов (о повадках этого микроба см. в заметке Бактерии-альтруисты помогают своим сородичам-каннибалам себя съесть, «Элементы», 27.02.2006). При наступлении неблагоприятных условий бактерии производят споры, способные переждать тяжелые времена. Процесс образования спор (споруляция) у B. subtilis изучен весьма подробно (рис. 2).
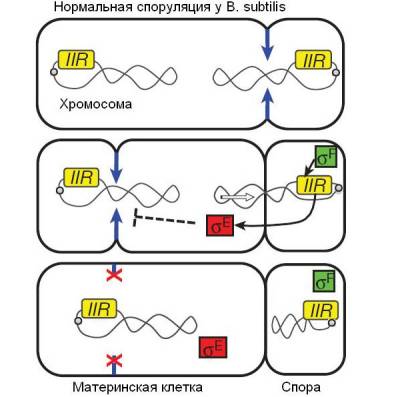
Рис. 2. Схема споруляции у B. subtilis. Синими стрелками показан процесс образования септы (перегородки), которая отделяет будущую спору от материнской клетки. Кольцевые хромосомы показаны в виде двух перекрученных петель (у большинства бактерий, как у B. subtilis, геном состоит из единственной кольцевой хромосомы). Регуляторный белок σF, образующийся в будущей споре, активизирует ген spoIIR, который на рисунке для краткости обозначен как IIR. Это приводит к тому, что другой сигнальный белок, σE, блокирует формирование второй септы на противоположном конце материнской клетки. Рисунок из обсуждаемой статьи в Nature
Авторы работали с 53 мутантными штаммами B. subtilis. Эти штаммы были сконструированы при помощи генно-инженерных методов. В геном бактерии вносились различные мутации, нарушающие нормальную работу (экспрессию) гена spoIIR. Этот ген необходим для того, чтобы формирующаяся спора могла передать в материнскую клетку сигнал, блокирующий формирование второй септы (рис. 2).
Хотя мутации были разные, фенотипический эффект у них оказался очень похожим. Во всех случаях произошла дестабилизация системы спорообразования. Вместо одного-единственного пути развития, который характерен для «диких» бактерий (образование одной споры в каждой клетке), бактерии-мутанты демонстрировали несколько разных вариантов развития, причем выбор того или иного варианта осуществлялся случайным образом. Генотип влиял только на вероятность, то есть частоту реализации каждого из них. Варианты были выявлены следующие (рис. 3):
1) Нормальная споруляция (как на рис. 2). В этом случае, несмотря на «вредную» мутацию, пытающуюся нарушить нормальный ход развития, белок σE всё равно образуется в материнской клетке в нужное время и в достаточном количестве. Поэтому образование второй септы своевременно блокируется, и дальнейшее развитие идет так же, как у «диких» бактерий. Это можно считать проявлением помехоустойчивости онтогенеза, а можно назвать «неполной пенетрантностью» вредной мутации, что по сути одно и то же.
2) Неудачная попытка образовать сразу две споры в одной материнской клетке. Белок σE вырабатывается в недостаточном количестве (или слишком поздно), и в результате вторая септа успевает сформироваться. Получается нежизнеспособная конструкция из двух незрелых спор, содержащих по хромосоме, а между ними — лишенная хромосомы материнская клетка. Это заканчивается гибелью всех троих.
3) Прерванная споруляция. Начавшийся процесс формирования споры прерывается, «зачаток» споры отмирает, а материнская клетка начинает расти. При этом в ней происходит репликация ДНК, то есть хромосома сначала удваивается, а потом иногда и утраивается. Такая клетка может затем перейти к обычному делению, а может «вспомнить», что собиралась заняться производством спор, и тогда начинается самое интересное: возникает вариант 4.
4) Споры-близнецы. Если в клетке, прервавшей споруляцию, произойдет утроение хромосомы, а потом споруляция возобновится, то получается материнская клетка с хромосомой, на концах которой образуются две жизнеспособные споры, тоже содержащие каждая по одной хромосоме. Эти споры в подходящих условиях нормально прорастают (то есть превращаются в обычных питающихся и делящихся бактерий) и вообще ничем не отличаются от нормальных спор B. subtilis.
5) Одиночная спора в диплоидной материнской клетке. Клетка с тремя хромосомами может произвести не две, а одну спору. В этом случае в материнской клетке остается две хромосомы. Спора при этом тоже получается нормальная, как и в варианте 4.
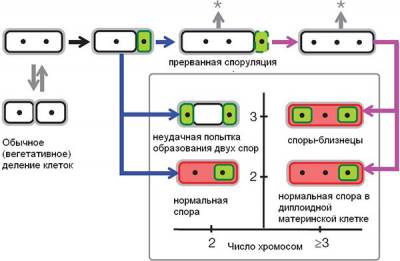
Рис. 3. Схема, показывающая альтернативные пути развития у бактерий с дестабилизированной системой споруляции. Черными точками показаны хромосомы. Зеленым цветом выделены формирующиеся споры (в них вырабатывается белок σF), красным — материнские клетки (в них вырабатывается белок σE). По горизонтальной оси — число хромосом, по вертикальной — число «отсеков», на которые разделилась исходная клетка. Стрелка со звездочкой символизирует возможность возвращения к обычному (вегетативному) размножению путем деления. Остальные пояснения см. в тексте. Рис. из обсуждаемой статьи в Nature
Таким образом, дестабилизация развития приводит к тому, что наряду с «нормой» (вариант 1) появляется четыре «морфоза», или альтернативных пути развития (варианты 2–5). Авторы показали, что весь этот спектр морфозов проявляется в генетически однородных популяциях каждого из 53 мутантных штаммов. Иными словами, мутантные бактерии с одинаковым геномом «выбирают» один из пяти путей развития случайным образом. От конкретной мутации — то есть от того, как именно нарушена работа гена spoIIR, — зависит лишь частота реализации этих путей.
Из четырех возникших морфозов один безусловно вреден (№2), два другие (№3 и №5) не создают ничего принципиально нового и вряд ли могут оказаться полезными — скорее всего, они приведут только к лишним тратам ресурсов, то есть окажутся неадаптивными.
Наиболее интересен морфоз №4 — образование жизнеспособных спор-близнецов. В принципе, такое изменение механизма споруляции может оказаться полезным — например, в том случае, если условия среды очень нестабильны, обычный способ размножения (простое деление клеток надвое) реализовать трудно и удобнее размножаться спорами.
Если формирование спор-близнецов может быть полезным, то следует ожидать, что у каких-нибудь бактерий такой способ размножения закрепился и стал нормой. Это действительно так: у многих бактерий из группы клостридий «близнецовая споруляция» является нормальным способом размножения. Авторы изучили близнецовую споруляцию у некоторых клостридий и пришли к выводу, что она протекает точно так же, как у мутантных B. subtilis. Надо сказать, что генные системы, управляющие споруляцией у клостридий и B. subtilis, гомологичны, то есть имеют единое происхождение, однако в природе у B. subtilis близнецовая споруляция никогда не встречается.
Итак, дестабилизация онтогенеза привела к появлению морфоза (аномального пути развития), который потенциально может оказаться полезным. Однако в исследованных мутантных штаммах этот путь развития реализуется лишь у небольшой части особей, то есть представляет собой весьма редкую аномалию. Сначала клетка должна «выбрать» вариант развития №3 («прерванная споруляция»); частота такого выбора зависит от конкретной мутации. Из особей, сделавших такой выбор, примерно 25% снова приступают к споруляции, а из них лишь у 5% образуются «споры-близнецы». Таким образом, потенциально полезный морфоз возникает у мутантов очень редко. Может ли он в дальнейшем зафиксироваться, то есть стать нормой?
Первопричиной этого морфоза, как и трех других, является изменение активности гена spoIIR (именно на активность этого гена влияют внесенные в геномы бактерий мутации). Однако авторы показали, что вероятность выбора клетками одного из возможных путей развития лишь на 15% определяется силой мутации (то есть тем, насколько изменилась экспрессия spoIIR). Остальные 85% вариабельности клеток по этому признаку зависят от случайности. Регулируя только лишь экспрессию spoIIR, невозможно добиться фиксации (стабилизации) одного из морфозов, даже повлиять на частоту его реализации можно лишь в очень узких пределах. Иными словами, такие мутации не могут отклонить путь развития в каком-то конкретном направлении — они могут только дестабилизировать систему, то есть внести элемент хаоса в «программу развития».
Следовательно, для того, чтобы полезный морфоз зафиксировался (был закреплен в геноме, говоря языком сторонников эпигенетической теории), необходимы какие-то дополнительные мутации. Какие именно и существуют ли они в природе? Чтобы ответить на этот вопрос, авторам пришлось изучить взаимовлияние двух процессов, играющих ключевую роль в споруляции. Первый процесс — это репликация ДНК, в ходе которой в клетке увеличивается число хромосом; второй — образование септ (перегородок, отделяющих будущую спору от материнской клетки).
Как выяснилось, вероятность формирования спор-близнецов у бактерий с дестабилизированным онтогенезом на самом деле зависит от комбинации двух факторов: скорости формирования септ и скорости репликации. Говоря упрощенно, для успешного образования спор-близнецов необходимо, чтобы в материнской клетке сначала образовалась дополнительная хромосома и только потом начала расти вторая септа. Если вторая септа образуется в материнской клетке с одной хромосомой, развитие пойдет по пути №2 и закончится гибелью. Если же вторая септа начнет образовываться в материнской клетке с двумя хромосомами, получатся споры-близнецы.
Авторы предположили, что можно увеличить вероятность образования спор-близнецов, повысив у мутантных бактерий темп репликации. Это предположение блестяще подтвердилось. Были испытаны две разные мутации, ускоряющие репликацию. В результате процент клеток, производящих по две жизнеспособные споры, вырос от долей процента до 30%, что сопоставимо с естественной частотой «близнецовой споруляции» у некоторых клостридий. Более того, ускорение репликации у мутантных B. subtilis привело к тому, что стал излишним «промежуточный» выбор варианта №3 (прерванная споруляция): клетки смогли осуществлять «близнецовую споруляцию» напрямую, минуя этап прерванной споруляции. Авторы также попробовали внести мутацию, ускоряющую репликацию, в геном «диких» B. subtilis, у которых ген spoIIR функционировал нормально. Это привело к тому, что у них иногда — в виде редкой аномалии — стали образовываться споры-близнецы.
Авторы справедливо отмечают, что дестабилизация развития может существенно облегчать формирование новых адаптаций. Дестабилизация как бы «перекидывает мостик» от одного стабильного состояния к другому, что особенно ценно в том случае, когда этот переход нельзя осуществить за счет одной-единственной мутации («перепрыгнуть пропасть одним прыжком»).
Действительно, чтобы бактерии, практикующие одиночную споруляцию, как B. subtilis, начали систематически (например, с вероятностью 30%) осуществлять близнецовую споруляцию, им недостаточно приобрести какую-то одну мутацию, которая сразу переведет их из одного устойчивого состояния в другое. Для этого нужны как минимум две мутации, одна из которых повысит темп образования септ (именно такой эффект дает изменение активности spoIIR), а другая увеличит скорость репликации, чтобы появление второй септы вело не к гибели, а к созданию двух жизнеспособных спор. Но две мутации не могут, как по заказу, появиться одновременно. Тут-то и приходит на помощь механизм дестабилизации онтогенеза. Первая мутация позволяет бактериям реализовать один из «скрытых» потенциальных путей развития — пусть и с очень низкой частотой. Если данный морфоз окажется выгодным (например, если в изменившихся условиях обычное размножение станет невозможным и размножаться смогут только те клетки, которым удалось осуществить близнецовую споруляцию), это даст шанс дестабилизированной популяции продержаться некоторое время, пока у какой-нибудь бактерии не возникнет вторая мутация, повышающая скорость репликации. Это приведет к тому, что редкая, но полезная аномалия закрепится, то есть станет новой нормой. В эволюции клостридий такое, по-видимому, происходило много раз.
Таким образом, данное исследование показало реалистичность сценария, предлагаемого сторонниками «эпигенетической теории эволюции» в качестве основного механизма эволюционных новообразований. Имеет ли смысл абсолютизировать этот механизм, как это делают некоторые авторы (то есть утверждать, что путь к новым адаптациям всегда лежит через дестабилизацию онтогенеза и последующую генетическую фиксацию морфозов) — это вопрос отдельный (и я склоняюсь к отрицательному ответу). Однако необходимо отметить, что если смотреть на новые признаки как на результат проявления «скрытых» путей развития, «предсуществующих» в системе индивидуального развития и определяемых структурой и внутренней логикой этой системы, то становится легче понять, почему прогрессивная эволюция на нашей планете в целом идет довольно бодрыми темпами. Можно показать (например, при помощи моделирования), что мутация, вмешивающаяся в развертывание сложной, устойчивой и саморегулирующейся программы развития, с большей вероятностью породит что-то новое и осмысленное, чем мутация, непосредственно и однозначно влияющая на конечный результат этого развития. Внеся случайное изменение в готовый осмысленный текст, мы почти наверняка его испортим. Но если у нас есть хорошая, «умная» программа генерации осмысленных текстов и мы вмешаемся в ее работу на каких-то относительно ранних этапах, то появится ненулевой шанс получить на выходе что-нибудь интересное.
Источник: Avigdor Eldar, Vasant K. Chary, Panagiotis Xenopoulos, Michelle E. Fontes, Oliver C. Loson, Jonathan Dworkin, Patrick J. Piggot, Michael B. Elowitz. Partial penetrance facilitates developmental evolution in bacteria // Nature. Advance online publication 5 July 2009.
Ссылка на источник